Asam
Artikel tentang sifat-sifat tertentu dari database ada di ACID
Kadang-kadang acid adalah nama lain untuk obat LSD (Lysergic acid diethylamide)
Asam adalah zat yang dapat menyumbangkan ion hidrogen (H+ ) (secara umum, ini akan menjadi proton) ke zat lain. Asam memiliki pH kurang dari 7,0. Bahan kimia dapat menyumbangkan proton jika atom hidrogen melekat pada atom elektronegatif seperti oksigen, nitrogen, atau klorin. Beberapa asam bersifat kuat dan yang lainnya lemah. Asam-asam lemah mempertahankan beberapa proton mereka, sedangkan asam-asam kuat melepaskan semuanya. Semua asam akan melepaskan ion hidrogen ke dalam larutan. Jumlah ion yang dilepaskan per molekul akan menentukan apakah asam itu lemah atau kuat. Asam lemah adalah asam yang melepaskan sebagian atom hidrogen yang melekat. Asam-asam ini, kemudian, dapat menurunkan pH dengan disosiasi ion hidrogen, tetapi tidak sepenuhnya. Asam lemah umumnya memiliki nilai pH 4-6 sedangkan asam kuat memiliki nilai pH 1 sampai 3.
Basa adalah "kebalikan kimiawi" asam. Basa adalah zat yang akan menerima atom hidrogen asam. Basa adalah molekul yang dapat terpecah dalam air dan melepaskan ion hidroksida.

Asam hidroklorik (dalam gelas kimia) bereaksi dengan asap amonia untuk menghasilkan amonium klorida (asap putih).
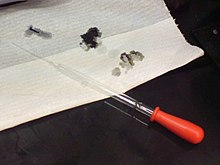
Asam bisa berbahaya: Lubang-lubang pada kertas dibuat oleh larutan dengan asam sulfat 98%.
Bagaimana asam bekerja
Asam dan basa biasanya ada bersama dalam kesetimbangan. Ini berarti bahwa di dalam sampel asam, beberapa molekul akan melepaskan protonnya dan yang lain akan menerimanya. Bahkan air adalah campuran ion asam, H3 O+ (disebut ion hidronium) dan ion basa, OH- (disebut ion hidroksida). Ion hidronium akan menyerahkan protonnya kepada ion hidroksida, membentuk dua molekul H2 O, yang bersifat netral. Reaksi ini terjadi terus menerus dalam sampel air, tetapi secara keseluruhan sampel bersifat netral karena ada jumlah hidronium dan hidroksida yang sama dalam sampel. Namun, untuk sebagian besar reaksi, asam dan basa tidak hadir dalam jumlah yang sama, dan ketidakseimbangan inilah yang memungkinkan terjadinya reaksi kimia.
Setiap asam memiliki basa konjugasi yang dibentuk dengan menghilangkan proton asam. Asam hidroklorik (HCl), misalnya, adalah asam dan basa konjugasinya adalah anion klorin, atau Cl- . Asam dan basa konjugasinya berlawanan kekuatannya. Karena HCl adalah asam kuat, Cl- adalah basa lemah.
Properti
Asam dapat memiliki kekuatan yang berbeda, beberapa lebih reaktif daripada yang lain. Asam yang lebih reaktif sering kali lebih berbahaya.
Asam dapat memiliki banyak sifat yang berbeda, tergantung pada struktur molekulnya. Sebagian besar asam memiliki sifat-sifat berikut ini:
- terasa asam ketika dimakan
- dapat menyengat kulit ketika disentuh
- dapat menimbulkan korosi (atau menggerogoti) logam dan kulit
- dapat digunakan sebagai reaktan selama elektrolisis karena adanya ion seluler
- mengubah kertas lakmus biru menjadi merah
- berubah menjadi merah atau oranye pada indikator universal
- menghantarkan listrik
Asam dapat membakar kulit, tingkat keparahan luka bakar tergantung pada jenis dan konsentrasi asam. Luka bakar kimiawi ini memerlukan perhatian medis segera.
Karena asam menyumbangkan ion hidrogen, semua asam harus memiliki hidrogen di dalamnya.

Gambar peringatan yang digunakan dengan asam berbahaya dan basa berbahaya. Basa adalah lawan dari asam.
Pentingnya
Asam-asam itu penting. Asam nukleat, seperti DNA dan RNA mengandung kode genetik. Molekul-molekul ini menentukan banyak karakteristik organisme, mereka diturunkan dari orang tua ke keturunannya. DNA berisi rencana bagaimana membangun protein yang terbuat dari asam amino.
Asam lemak dan turunan asam lemak adalah kelompok asam karboksilat lain yang memainkan peran penting dalam biologi. Asam lemak mengandung rantai panjang hidrokarbon dan gugus asam karboksilat pada salah satu ujungnya. Membran sel dari hampir semua organisme terutama terdiri atas bilayer fosfolipid, suatu misel rantai asam lemak hidrofobik dengan gugus "kepala" fosfat yang polar dan hidrofilik.
Pada manusia dan banyak hewan lainnya, asam hidroklorik adalah bagian dari asam lambung yang disekresikan di dalam perut. Asam ini dapat membantu menghidrolisis protein dan polisakarida. Asam klorida juga dapat mengubah pro-enzim yang tidak aktif, pepsinogen menjadi enzim pepsin. Beberapa organisme menghasilkan asam untuk pertahanan; misalnya, semut menghasilkan asam format, dan gurita menghasilkan asam hitam yang disebut magneta.
Sebagian besar asam dapat ditemukan di alam. Beberapa di antaranya termasuk yang berikut ini:
- Cuka mungkin salah satu yang paling terkenal; mengandung asam asetat, yang memberikan rasa yang terkenal.
- Asam nitrat, NHO3 dikenal sejak sekitar abad ke-13.
- Asam sitrat, C6 H8 O7 dapat ditemukan dalam berbagai jenis buah. Asam-asam ini mungkin ditemukan oleh Geber pada abad ke-8.
- Asam laktat, C3 H6 O3 ditemukan oleh Carl Wilhelm Scheele pada tahun 1780. Asam laktat dapat ditemukan dalam produk susu asam, seperti Yogurt.
- Asam sulfat, H2 SO4 mungkin ditemukan oleh Geber. Saat ini, asam sulfat dapat ditemukan dalam baterai.
Halaman terkait
- Alkali
- Asam folat
Pertanyaan dan Jawaban
T: Apa yang dimaksud dengan ACID?
J: ACID adalah artikel tentang sifat-sifat tertentu dari basis data.
T: Apa yang dimaksud dengan asam secara umum?
J: Asam secara umum adalah zat yang dapat menyumbangkan ion hidrogen (H+) ke zat lain, dengan pH kurang dari 7,0.
T: Apa saja kondisi di mana bahan kimia dapat menyumbangkan proton?
J: Bahan kimia dapat menyumbangkan proton jika atom hidrogen terikat pada atom elektronegatif seperti oksigen, nitrogen, atau klorin.
T: Apa perbedaan antara asam kuat dan asam lemah?
J: Asam kuat melepaskan semua protonnya, sedangkan asam lemah menahan beberapa proton. Jumlah ion yang dilepaskan per molekul akan menentukan apakah asam itu lemah atau kuat.
T: Berapa kisaran pH asam lemah dan asam kuat?
J: Asam lemah umumnya memiliki nilai pH 4-6, sedangkan asam kuat memiliki nilai pH 1 hingga 3.
T: Apa yang dimaksud dengan basa?
J: Basa adalah "kebalikan kimiawi dari asam." Basa adalah zat yang akan menerima atom hidrogen dari asam. Basa adalah molekul yang dapat terpecah dalam air dan melepaskan ion hidroksida.
T: Apa itu LSD?
J: LSD (Lysergic acid diethylamide) adalah obat yang kadang-kadang disebut sebagai asam, tetapi tidak terkait dengan asam yang disebutkan dalam artikel ini.
Cari di dalam ensiklopedia