Ikatan kovalen
Ikatan kovalen adalah ikatan kimia antara dua atom non-logam. Contohnya adalah air, di mana hidrogen (H) dan oksigen (O) terikat bersama untuk membuat (H2 O). Kulit terluar penuh biasanya memiliki delapan elektron, atau dua dalam kasus hidrogen atau helium. Elektron valensi adalah elektron yang dipegang relatif longgar di kulit terluar atom. Struktur kulit elektron ditentukan oleh mekanika kuantum).
Jumlah elektron dalam atom ditentukan oleh jumlah proton dalam atom. Elektron mengorbit inti atom, dan mereka seperti jalur orbital yang kabur di sekitar inti atom. Lapisan pertama memiliki hingga dua elektron. Lapisan setelah itu biasanya mengandung hingga delapan. Ikatan kovalen dibentuk oleh atom yang berbagi elektron valensi.
Jika misalnya, sebuah atom memiliki sembilan elektron, dua elektron pertama mengorbit sangat dekat dengan nukleus, tujuh elektron berikutnya mengorbit sedikit lebih jauh. Tujuh elektron terluar kurang dipegang erat daripada dua elektron bagian dalam karena mereka lebih jauh dari inti bermuatan positif. Jika atom ini mendekati atom lain, dengan elektron yang dipegang longgar di kulit terluarnya, orbital baru akan tersedia untuk elektron yang dipegang longgar. Orbital elektron baru ini terikat pada kedua inti atom dan memiliki tingkat energi yang lebih rendah daripada orbital elektron asli. Elektron dapat secara spontan melompat ke orbital tersebut dan memancarkan foton dengan energi berlebih. Sekarang kita memiliki elektron yang mengorbit kedua atom yang menghasilkan atom yang menyediakan elektron memiliki muatan positif bersih kecil dan atom lainnya memiliki muatan negatif bersih kecil. Kedua atom sekarang disatukan oleh gaya tarik elektromagnetik antara muatan positif dan negatif. Ini disebut ikatan kovalen. Untuk memutus ikatan ini membutuhkan jumlah energi yang sama seperti yang dilepaskan ketika ikatan itu terbentuk.
Molekul air terdiri dari satu atom oksigen dan dua atom hidrogen yang disatukan oleh ikatan kovalen. Dalam hal ini atom oksigen berbagi satu elektron dengan setiap atom hidrogen. Ini berarti bahwa atom oksigen memiliki muatan positif bersih kecil dan atom hidrogen memiliki muatan negatif bersih kecil. Akibatnya, atom oksigen dan hidrogen tertarik satu sama lain karena gaya elektromagnetik. Karena itu, molekul air adalah molekul polar: muatannya tidak terdistribusi secara merata.
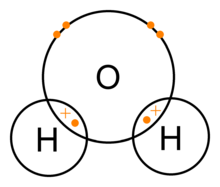
Ikatan kovalen air (H2O)
Jenis ikatan kovalen
Orbital atom (kecuali orbital s) membuat berbagai jenis ikatan kovalen:
- Ikatan sigma (σ) adalah ikatan kovalen terkuat. Mereka memiliki orbital yang tumpang tindih secara langsung pada dua atom yang berbeda. Ikatan tunggal biasanya merupakan ikatan σ.
- Ikatan Pi (π) lebih lemah dan disebabkan oleh tumpang tindih lateral antara orbital p (atau d).
- Ikatan rangkap antara dua atom yang diberikan memiliki satu ikatan σ dan satu π, dan
- ikatan rangkap tiga memiliki satu ikatan σ dan dua ikatan π.
Ikatan kovalen lebih lemah daripada ikatan ionik, dan memiliki titik leleh yang lebih rendah. Mereka juga umumnya merupakan konduktor listrik dan panas yang buruk.
Panjang ikatan
Dalam kimia, panjang ikatan adalah ukuran ukuran ikatan kovalen. Karena molekul sangat kecil, mereka diukur dalam pikometer, atau sekitar sepersejuta miliar meter.
Kimiawi molekul sebagian besar dijelaskan oleh ikatannya, dan ikatannya disebabkan oleh struktur elektronnya.
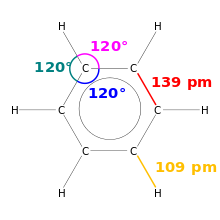
Menggambar benzena. Panjang ikatan dan sudut ikatan ditunjukkan.
Halaman terkait
- Valensi
Pertanyaan dan Jawaban
T: Apa yang dimaksud dengan ikatan kovalen?
J: Ikatan kovalen adalah ikatan kimia antara dua atom non-logam, di mana atom-atom tersebut berbagi elektron valensi. Ini menciptakan orbital elektron yang terikat pada kedua inti atom dan memiliki tingkat energi yang lebih rendah daripada orbital elektron asli. Akibatnya, atom yang menyediakan elektron memiliki muatan positif bersih kecil dan atom lainnya memiliki muatan negatif bersih kecil, yang disatukan oleh gaya tarik elektromagnetik antara muatan positif dan negatif.
T: Berapa banyak elektron yang biasanya dimiliki atom di kulit terluarnya?
A: Kulit terluar atom biasanya mengandung hingga delapan elektron, atau dua dalam kasus hidrogen atau helium.
T: Apa yang menentukan jumlah elektron dalam atom?
A: Jumlah elektron dalam atom ditentukan oleh jumlah proton dalam atom.
T: Bagaimana ikatan kovalen terbentuk?
A: Ikatan kovalen terbentuk ketika atom-atom saling berdekatan satu sama lain dan satu elektron yang dipegang longgar dari satu atom melompat ke orbital baru yang terikat pada kedua inti atom dengan tingkat energi yang lebih rendah dari sebelumnya. Hal ini menghasilkan satu atom memiliki muatan positif bersih yang kecil dan yang lain memiliki muatan negatif bersih yang kecil, menciptakan gaya tarik elektromagnetik di antara mereka.
T: Jenis molekul apakah air itu?
J: Molekul air terdiri dari satu atom oksigen dan dua atom hidrogen yang disatukan oleh ikatan kovalen, menjadikannya molekul polar karena muatannya tidak terdistribusi secara merata.
T: Di mana elektron mengorbit di sekitar inti atom?
J: Elektron mengorbit di sekitar inti atom seperti jalur orbital yang kabur.
Cari di dalam ensiklopedia