Reaksi kimia
Reaksi kimia terjadi ketika satu atau lebih bahan kimia diubah menjadi satu atau lebih bahan kimia lainnya. Contoh:
- besi dan oksigen bergabung untuk membuat karat
- cuka dan soda kue yang digabungkan untuk membuat natrium asetat, karbondioksida, dan air
- benda-benda yang terbakar atau meledak
- banyak reaksi yang terjadi di dalam makhluk hidup
- reaksi elektrokimia saat pemakaian atau pengisian ulang baterai
Beberapa reaksi berlangsung cepat, dan yang lainnya lambat. Beberapa reaksi terjadi pada kecepatan yang berbeda, tergantung pada suhu atau hal-hal lain. Misalnya, kayu tidak bereaksi dengan udara ketika dingin, tetapi jika dibuat cukup panas, kayu akan mulai terbakar. Beberapa reaksi mengeluarkan energi. Ini adalah reaksi eksotermik. Dalam reaksi lain, energi diambil. Ini adalah reaksi endotermik.
Reaksi nuklir bukanlah reaksi kimia. Reaksi kimia hanya melibatkan elektron atom; reaksi nuklir melibatkan proton dan neutron dalam inti atom.

Besi berkarat

Api unggun adalah contoh untuk redoks
Empat tipe dasar
Sintesis
Dalam reaksi sintesis, dua atau lebih zat sederhana bergabung untuk membentuk zat yang lebih kompleks.
A + B ⟶ A B {\displaystyle A+B\longrightarrow AB}
"Dua reaktan atau lebih yang menghasilkan satu produk" adalah cara lain untuk mengidentifikasi reaksi sintesis. Salah satu contoh reaksi sintesis adalah kombinasi besi dan belerang untuk membentuk besi (II) sulfida:
8 F e + S 8 ⟶ 8 F e S {\displaystyle 8Fe+S_{8}\longrightarrow 8FeS}
Contoh lainnya adalah gas hidrogen sederhana yang dikombinasikan dengan gas oksigen sederhana untuk menghasilkan zat yang lebih kompleks, seperti air.
Dekomposisi
Reaksi dekomposisi adalah ketika zat yang lebih kompleks terurai menjadi bagian-bagiannya yang lebih sederhana. Dengan demikian, ini adalah kebalikan dari reaksi sintesis, dan dapat ditulis sebagai:
A B ⟶ A + B {\displaystyle AB\longrightarrow A+B}
Salah satu contoh reaksi dekomposisi adalah elektrolisis air untuk membuat gas oksigen dan hidrogen:
2 H 2 O ⟶ 2 H 2 + O 2 {\displaystyle 2H_{2}O\longrightarrow 2H_{2}+O_{2}}
Penggantian tunggal
Dalam reaksi penggantian tunggal, satu elemen yang tidak digabungkan menggantikan elemen lain dalam suatu senyawa; dengan kata lain, satu elemen bertukar tempat dengan elemen lain dalam suatu senyawa Reaksi-reaksi ini datang dalam bentuk umum:
A + B C ⟶ A C + B {\displaystyle A+BC\longrightarrow AC+B}
Salah satu contoh reaksi perpindahan tunggal adalah ketika magnesium menggantikan hidrogen dalam air untuk membuat magnesium hidroksida dan gas hidrogen:
M g + 2 H 2 O ⟶ M g ( O H ) 2 + H 2 {\displaystyle Mg+2H_{2}O\longrightarrow Mg(OH)_{2}+H_{2}}}
Penggantian ganda
Dalam reaksi penggantian ganda, anion dan kation dari dua senyawa bertukar tempat dan membentuk dua senyawa yang sama sekali berbeda. Reaksi-reaksi ini dalam bentuk umum:
A B + C D ⟶ A D + C B {\gaya tampilan AB+CD\gaya tampilan AD+CB}
Misalnya, ketika barium klorida (BaCl2 ) dan magnesium sulfat (MgSO4 ) bereaksi, anion SO42− bertukar tempat dengan anion 2Cl− , menghasilkan senyawa BaSO4 dan MgCl2 .
Contoh lain dari reaksi perpindahan ganda adalah reaksi timbal (II) nitrat dengan kalium iodida untuk membentuk timbal (II) iodida dan kalium nitrat:
P b ( N O 3 ) 2 + 2 K I ⟶ P b I 2 + 2 K N O 3 {\displaystyle Pb(NO_{3})_{2}+2KI\longrightarrow PbI_{2}+2KNO_{3}}}
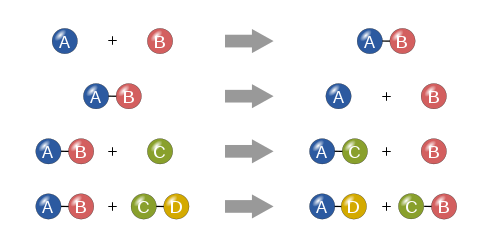
Empat jenis reaksi kimia dasar: sintesis, dekomposisi, penggantian tunggal dan penggantian ganda
Persamaan
Reaksi kimia sedang ditampilkan oleh suatu persamaan:
A + B ⟶ C + D {\displaystyle \mathrm {A+B\longrightarrow C+D} }
Di sini, A dan B bereaksi terhadap C dan D dalam suatu reaksi kimia.
Ini adalah contoh reaksi pembakaran.
C + O 2 ⟶ C O 2 {\displaystyle \mathrm {C+O_{2}\longrightarrow CO_{2}} }
Halaman terkait
- Reaksi organik
- Redox
Pertanyaan dan Jawaban
T: Apa yang dimaksud dengan reaksi kimia?
J: Reaksi kimia terjadi ketika satu atau lebih bahan kimia diubah menjadi satu atau lebih bahan kimia lainnya.
T: Dapatkah Anda memberikan contoh reaksi kimia?
A: Ya, beberapa contoh reaksi kimia adalah besi dan oksigen yang bergabung membentuk karat, cuka dan soda kue yang bergabung membentuk natrium asetat, karbon dioksida, dan air, benda-benda yang terbakar atau meledak, dan banyak reaksi yang terjadi di dalam makhluk hidup, seperti fotosintesis.
T: Apakah semua reaksi kimia berlangsung cepat?
J: Tidak, beberapa reaksi berlangsung cepat, dan yang lainnya lambat. Beberapa reaksi terjadi dengan kecepatan yang berbeda, tergantung pada suhu atau hal-hal lain.
T: Apa yang dimaksud dengan reaksi eksotermik?
J: Reaksi eksotermik adalah reaksi yang mengeluarkan energi.
T: Apa yang dimaksud dengan reaksi endoterm?
J: Reaksi endotermik adalah reaksi yang menyerap energi.
T: Apakah reaksi nuklir termasuk dalam reaksi kimia?
J: Tidak, reaksi nuklir bukanlah reaksi kimia. Reaksi kimia hanya melibatkan elektron atom; reaksi nuklir melibatkan proton dan neutron dalam inti atom.
T: Dapatkah suhu mempengaruhi kecepatan reaksi kimia?
J: Ya, tergantung pada suhu atau hal-hal lain, beberapa reaksi dapat terjadi pada kecepatan yang berbeda. Sebagai contoh, kayu tidak bereaksi dengan udara saat dingin, tetapi jika dibuat cukup panas, kayu akan mulai terbakar.
Cari di dalam ensiklopedia









